什(shén)麽是CDX腫瘤模型
CDX(人(rén)源腫瘤細胞系異種移植,cell derived xenograft)模型主要是将腫瘤細胞系移植到裸鼠或者NSG小鼠體内而構建的(de)腫瘤模型,而由于腫瘤細胞系是經過人(rén)工純化(huà)以及多(duō)代培養的(de)細胞系,所以其構建的(de)CDX模型是無法保持腫瘤組織的(de)異質性的(de)。同時(shí)由于其經過了(le)多(duō)次的(de)傳代(幾十次傳代),所以生物(wù)學特征變化(huà)明(míng)顯,從而使得(de)其生物(wù)學特性以及藥效評價結果與臨床相似度極低。
什(shén)麽是PDX腫瘤模型
PDX(人(rén)源腫瘤組織來(lái)源移植瘤模型 ,patientl derived xenograft)模型是将腫瘤組織以組織的(de)形勢移植至NSG小鼠體内,從而很好的(de)保持了(le)腫瘤的(de)異質性。同時(shí)PDX模型是将腫瘤組織直接移植到NSG小鼠體内,并沒有經過任何人(rén)工培養,所以其生物(wù)學特性保持的(de)更加完整,與臨床相似度更高(gāo),是現階段最優秀的(de)腫瘤動物(wù)模型。
早在20世紀90年代早期,美(měi)國國立癌症研究所(National Cancer Institute, NCI)就 依據來(lái)源于9種不同類型腫瘤(腦(nǎo),結腸癌,白血病,肺,黑(hēi)素瘤、卵巢癌、腎癌、乳腺癌和(hé)前列腺癌) 的(de)60位癌症患者腫瘤細胞系,引入了(le)一種”disease-oriented”的(de)藥物(wù)篩選策略,簡單來(lái)說,就是先用(yòng)人(rén)腫瘤細胞系進行高(gāo)通(tōng)量體外藥物(wù)篩選,再用(yòng)CDX模型進行體内驗證,由于CDX模型細胞系容易獲得(de),有大(dà)量已發表的(de)文獻關于其基因組學、細胞功能學及藥效反應的(de)數據可(kě)供參考,建模成本低等優勢,在當時(shí)可(kě)以說是風靡各大(dà)實驗室。
但是2016年,NCI卻決定從其藥篩系統中讓已經使用(yòng)了(le)25年的(de)NCI60細胞系“退休!
爲什(shén)麽會發生這(zhè)種轉變?!
原來(lái),研究者逐漸發現人(rén)源腫瘤細胞系經長(cháng)期體外培養後, 其腫瘤細胞生物(wù)學行爲及基因譜表達水(shuǐ)平、 腫瘤異質性都與原始腫瘤組織存在較大(dà)的(de)差異, 從而在預測臨床藥效方面不甚理(lǐ)想。有研究表明(míng), 經此模型鑒定篩選的(de)藥物(wù)僅約 1/3在二期臨床試驗中驗證有效。
不過,長(cháng)江後浪推前浪,退休了(le)CDX,就會有更優秀的(de)腫瘤模型崛起!
既然能使科研界沿用(yòng)幾十年的(de)CDX被“退休”,那就必然代表新生力量PDX青出于藍,目前該模型被研究者普遍認可(kě)的(de)優勢主要包括:
1、移植所用(yòng)标本直接來(lái)源于人(rén)體腫瘤組織,未經過體外培養,穩定地保留了(le)腫瘤的(de)遺傳特性、組織學和(hé)表型特征,即腫瘤異質性;
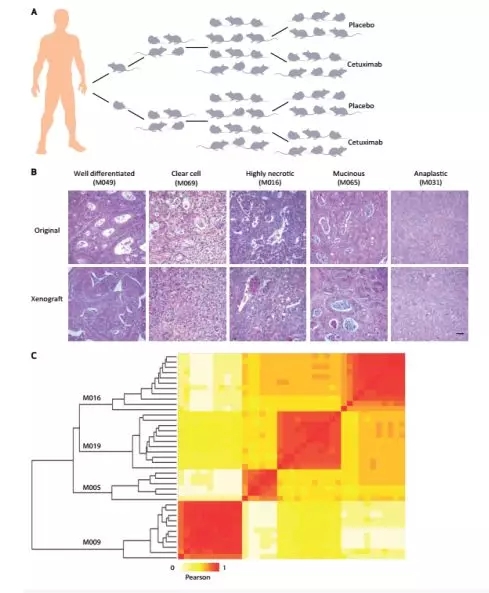
如下(xià)圖所示,爲構建的(de)人(rén)源結直腸癌小鼠移植模型,通(tōng)過不同形态學特征的(de)組織染色,發現在某些情況下(xià),新鮮病竈和(hé)傳代病竈均表現出良好的(de)分(fēn)化(huà)表型,某些樣本均出現透明(míng)細胞,黏液分(fēn)泌細胞和(hé)細胞壞死區(qū)域等,同時(shí),少數腫瘤表現出高(gāo)度的(de)多(duō)形性,保持未分(fēn)化(huà)狀态(Fig2B)。
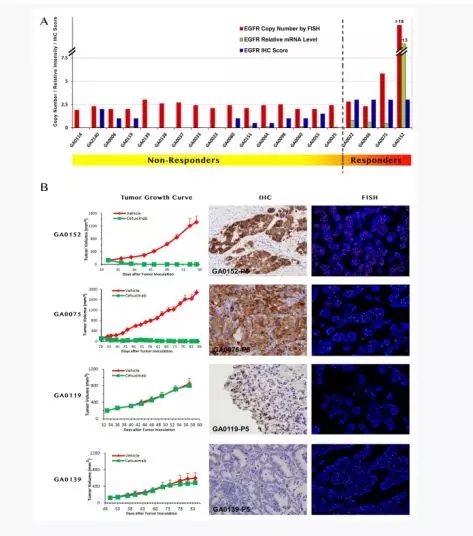
2、PDX可(kě)用(yòng)于篩選化(huà)療藥物(wù)敏感或耐藥标記物(wù),其試驗結果具有較好的(de)臨床預見性
以胃癌PDX爲例,圖A表示對(duì) cetuximab治療不敏感與敏感小鼠中EGFR DNA/mRNA/EGFR受體蛋白拷貝數差異,發現敏感小鼠中拷貝數普遍較高(gāo),并且通(tōng)過腫瘤生長(cháng)曲線,IHC, FISH對(duì)比,最終得(de)出:對(duì) cetuximab敏感的(de)小鼠模型,其EGFR表達普遍上調。
除此外,另有PDX在移植過程中較好地保留了(le)腫瘤間質和(hé)幹細胞成分(fēn),使得(de)腫瘤的(de)生長(cháng)微環境更接近實際情況,還(hái)可(kě)爲腫瘤樣本的(de)保存和(hé)傳代提供大(dà)量标本等。
建模是爲了(le)什(shén)麽?篩藥!
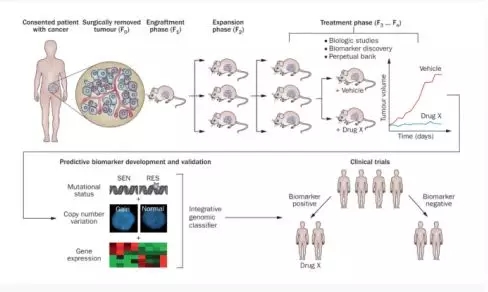
這(zhè)些荷瘤小鼠可(kě)以作爲病人(rén)的(de)“替身”(avatar),代替病人(rén)去測試不同藥物(wù)方案的(de)治療效果,從中篩選出最有效的(de)治療方案,從而避免藥物(wù)毒副作用(yòng)以及經濟上的(de)浪費,具體流程參照(zhào)下(xià)圖。
當然了(le),雖然PDX優勢頗多(duō),但局限性也(yě)不容忽視。
目前PDX模型原始腫瘤的(de)主要來(lái)源爲手術切除,建模難度高(gāo)且不能反複獲取,構建時(shí)間長(cháng)且成功率不穩定,随著(zhe)傳代次數增加腫瘤微環境也(yě)會逐漸被小鼠細胞外基質取代,因此對(duì)于傳代次數有一定限制。值得(de)一提的(de)是,負荷腫瘤的(de)小鼠均爲免疫缺陷的(de)小鼠,因而該模型也(yě)無法用(yòng)于篩選免疫相關藥物(wù)。
總的(de)來(lái)說,兩種模型各有千秋,某種程度上CDX可(kě)以被認爲是傳代次數太多(duō)已經難以追溯的(de)PDX模型,經過體内外交替傳代,原始腫瘤組織中隻有最适應體外培養條件的(de)單個(gè)克隆被保留下(xià)來(lái),喪失了(le)克隆異質性,從而難以對(duì)臨床藥效進行預測。
而PDX最大(dà)的(de)優勢也(yě)在于此,保留了(le)腫瘤異質性,更符合臨床腫瘤特征。
 協同生物(wù)
協同生物(wù)





